Menu
O Onyx Frontier™ é um stent farmacológico (DES) para doença arterial coronariana. Foi projetado para ser administrado, com design diferente e otimizado para intervenções coronárias percutâneas (ICP) complexas.
O Onyx Frontier DES apresenta um sistema de entrega aprimorado † e foi projetado para levar o desempenho agudo do Resolute Onyx™ DES ainda mais longe.
O Onyx Frontier DES apresenta os mesmos diferenciadores de design de stent que fornecem a conformabilidade, 1 visibilidade, 2 cura rápida, 3 e matriz de tamanho em que você confia com o Resolute Onyx DES.
Onyx Frontier DES foi projetado para oferecer: 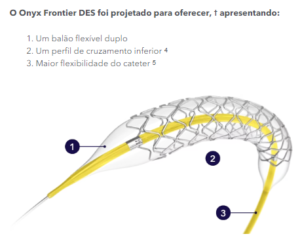
A segurança e a eficácia do stent Resolute Onyx™ ainda não foram estabelecidas nas seguintes populações de pacientes:
A segurança e a eficácia do stent Resolute Onyx™ não foram estabelecidas na vasculatura cerebral, carotídea ou periférica. Além disso, a segurança e a eficácia do uso de dispositivos de aterectomia com o stent Resolute Onyx™ não foram estabelecidas. O efeito de possíveis interações medicamentosas na segurança ou eficácia do stent Resolute Onyx™ não foi investigado. Interações potenciais do stent Resolute Onyx™ com outros stents revestidos ou com eluição de drogas não foram avaliadas e devem ser evitadas sempre que possível.
Os estudos clínicos do stent Resolute™ não sugeriram quaisquer diferenças significativas na segurança e eficácia para pacientes do sexo masculino e feminino e não incluíram um número suficiente de pacientes para avaliar as diferenças na segurança e eficácia devido à etnia.
As decisões sobre a duração da DAPT são tomadas individualmente e devem integrar o julgamento clínico, a avaliação da relação benefício/risco e a preferência do paciente. A descontinuação ou interrupção prematura da medicação antiplaquetária prescrita pode resultar em maior risco de trombose de stent, infarto do miocárdio ou morte. Antes da ICP, se for prevista a descontinuação prematura da terapia antiplaquetária, os médicos devem avaliar cuidadosamente com o paciente se um DES e seu esquema DAPT recomendado associado é a escolha apropriada para ICP.
Após a ICP, se for considerada uma cirurgia não cardíaca eletiva que requeira a suspensão da terapia antiplaquetária, os riscos e benefícios do procedimento devem ser avaliados contra o possível risco associado à interrupção da terapia antiplaquetária. Os pacientes que necessitam de descontinuação prematura da DAPT devem ser cuidadosamente monitorados quanto a eventos cardíacos. A critério do(s) médico(s) assistente(s) do paciente, a terapia antiplaquetária deve ser reiniciada o mais rápido possível.
As potenciais reações adversas em lactentes de zotarolimus não foram determinadas. Os perfis farmacocinéticos e de segurança do zotarolimus em lactentes não são conhecidos.
A Supri é importadora e distribuidora de artigos e equipamentos médicos e hospitalares. Somos uma empresa comprometida com qualidade e excelência de atendimento.





Canal de Denúncia
Caso tenha encontrado alguma irregularidade você pode realizar denúncias, reclamações e solicitações.